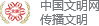细胞外泌体携带多种蛋白质、mRNA、miRNA,参与细胞通讯、细胞迁移、血管新生和肿瘤细胞生长等过程并且有可能成为药物的天然载体,应用于临床治疗。然而,测量技术手段的局限限制了外泌体在这些领域的研究进展。这篇文章总结了外泌体的纯化方法,比较了现存各种外泌体测量技术,并重点介绍了一种新的测量技术,即纳米微粒追踪分析术,在外泌体尺寸和表征研究中的应用。
1.外泌体提取及方法学评价
到目前为止,仍没有一种提取方法能同时保证外泌体的含量、纯度以及生物活性。
1.1 离心法
这是目前外泌体提取最常用的方法。简单来说,收集细胞培养液以后依次在300 g、2 000 g、10 000 g离心去除细胞碎片和大分子蛋白质,最后100 000 g离心得到外泌体。此种方法得到的外泌体量多,但是纯度不足,电镜鉴定时发现外泌体聚集成块,由于微泡和外泌体没有非常统一的鉴定标准,也有一些研究认为此种方法得到的是微泡不是外泌体。
1.2 过滤离心
过滤离心是利用不同截留相对分子质量(MWCO)的超滤膜离心分离外泌体。截留相对分子质量是指能自由通过某种有孔材料的分子中最大分子的相对分子质量。外泌体是一个囊状小体,相对分子质量大于一般蛋白质,因此选择不同大小的MWCO膜可使外泌体与其他大分子物质分离。这种操作简单、省时,不影响外泌体的生物活性,但同样存在纯度不足的问题。
1.3 密度梯度离心法
密度梯度离心是将样本和梯度材料一起超速离心,样品中的不同组分沉降到各自的等密度区,分为连续和不连续梯度离心法。用于密度梯度离心法的介质要求对细胞无毒,在高浓度时粘度不高且易将pH调至中性。实验中常用蔗糖密度梯度离心法,在离心法的基础上,预先将两种浓度蔗糖溶液(如2.5 M 和0.25 M)配成连续梯度体系置于超速离心管中,样本铺在蔗糖溶液上,100 000 g离心16 h,外泌体会沉降到等密度区(1.10~1.18 g/ml)。用此种方法分离到的外泌体纯度高,但是前期准备工作繁杂,耗时,量少。
1.4 免疫磁珠法
免疫磁珠是包被有单克隆抗体的球型磁性微粒,可特异性地与靶物质结合。同样,在离心法的基础上,预先使磁珠包被针对外泌体相关抗原的抗体(如CD9、CD63、Alix)与外泌体共同孵育,蒸馏水冲洗后,重悬于PBS缓冲液中。这种方法可以保证外泌体形态的完整,特异性高、操作简单、不需要昂贵的仪器设备, 但是非中性pH和非生理性盐浓度会影响外泌体生物活性,不便进行下一步的实验。
1.5 色谱法
色谱法是利用根据凝胶孔隙的孔径大小与样品分子尺寸的相对关系而对溶质进行分离的分析的方法。样品中大分子不能进入凝胶孔,只能沿多孔凝胶粒子之间的空隙通过色谱柱,首先被流动相洗脱出来;小分子可进入凝胶中绝大部分孔洞,在柱中受到更强地滞留,更慢地被洗脱出。分离到的外泌体在电镜下大小均一,但是需要特殊的设备,应用不广泛。
2.外泌体测量各种方法的比较
2.1 电子显微镜
扫描电子显微镜(SEM)的工作原理是以能量为1-30KV间的电子束,以光栅状扫描方式照射到被分析试样的表面上,利用入射电子和试样表面物质相互作用所产生的二次电子和背散射电子成象,获得试样表面微观组织结构和形貌信息,并且具有较高的分辨率。由于超高真空技术的发展,场发射电子枪的应用得到普及,现代先进的扫描电镜的分辨率已经达到1纳米左右,足够用来进行外泌体尺寸的测量。鉴于SEM的工作特点,在外泌体研究中,能够直接观察到样品中外泌体的形态。并且SEM具有很高的分辨率,能够鉴别不同大小的外泌体。但SEM对样品的预处理和制备上面要求较高,样品的准备阶段比较复杂,不适合对外泌体进行大量快速的测量。而且由于外泌体经过了预处理和制备过程,无法准确的进行外泌体浓度的测量。
2.2 动态光散射技术
动态光散射是收集溶液中做布朗运动的颗粒散射光强度起伏的变化,通过相关仪?器将光强的波动转化为相关曲线,从而得到光强波动的速度,计算出粒子的扩散速度信息和粒子的粒径。小颗粒样品的布朗运动速度快,光强波动较快,相关曲线衰减较快,大颗粒反之(图1)。
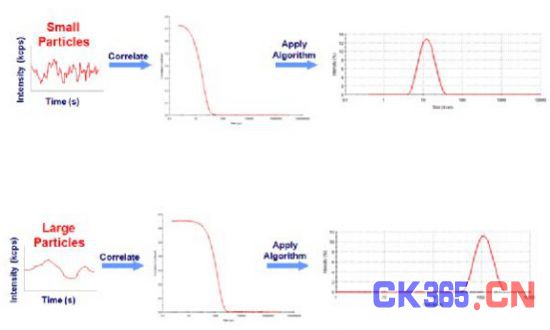
图1 大颗粒和小颗粒光强波动及相关曲线
在外泌体研究中,动态光散射测量敏感度较高,测量下限为10纳米。相对于SEM技术来说,样品制备简单,只需要简单的过滤,测量速度较快。但由于动态光散射技术是测量光强的波动数据,所以大颗粒的光强波动信号会掩盖较小颗粒的光强波动信号,所以动态光散射不适合大小不一的复杂外泌体样本的测量,只适合通过色谱法制备的大小均一的外泌体的尺寸测量,并且无法测量样品中外泌体的浓度。
2.3 纳米微粒追踪分析术
纳米微粒追踪分析术(以下简称NTA)是一种比较新颖的研究纳米颗粒的方法,可以直接和实时的观测纳米颗粒。NTA通过光学显微镜收集纳米颗粒的散射光信号,拍摄一段纳米颗粒在溶液中做布朗运动的影像,对每个颗粒的布朗运动进行追踪和分析,从而计算出纳米颗粒的流体力学半径和浓度。
NTA系统的工作原理是将一束能量集中的激光穿过玻璃棱镜对样品(悬浮颗粒的溶液)进行照射(光路图见图2)
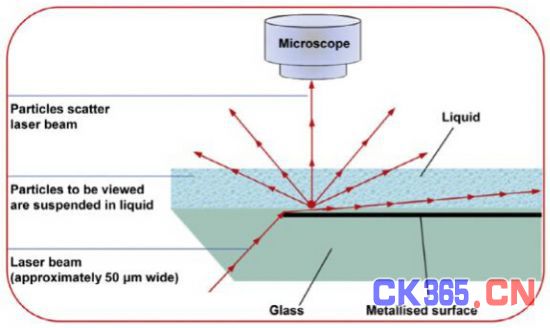
图2 NTA激光光路图
激光光束从较小角度入射进入样品溶液,照亮溶液中的颗粒。配备相机的光学显微镜,被放置在特定的位置上,收集视野中被照亮的纳米颗粒发射出的光散射信号。 样品池有大约500微米的深度,采样点激光照亮宽度为20微米,这个数值和光学显微镜的聚焦的视野深度相匹配。相机会进行60秒的影像拍摄,每秒30个采样画面。颗粒的运动过程被NTA软件进行分析。NTA软件在每幅被记录的画面中鉴别和追踪做布朗运动的纳米颗粒。
根据颗粒的运动速度,通过二维 Stokes-Einstein方程计算颗粒流体力学半径

在方程中2是均方位移,KB是Boltzmann常数; T是溶液的温度,单位是Kelvin; ts是采样时间,例如,1/30 fpsec = 33 msec; η是溶液粘度;dh是流体力学直径。 NTA检测颗粒大小的范围和颗粒本身的折光指数相关。测量的下限取决于被研究颗粒和背景之间信噪比,也就是颗粒的散射光强度和背景的光强差距。颗粒的散射光强度根据Rayleigh散射方程,受到以下因素的影响

其中,d是颗粒的直径,λ是入射光的波长,n是颗粒和溶液的折光系数比。通常来说,生物样品,如外泌体等,折光系数较低,所以测量下限为30-40纳米。
由于直接追踪样品中每一个纳米颗粒,因此NTA技术对复杂的样品具有极高的分辨率。为了证明NTA对于复杂样品的分辨能力,我们将100纳米和300纳米两种不同大小的聚苯乙烯颗粒按照5:1的数量混合,使用NTA进行测量(图3A)。尽管其分布图形有一定的重叠,但两种不同大小的纳米颗粒的峰清楚的区分开来。这种对复杂样品的分辨能力对于外泌体这样的研究对象来说是非常重要的。
NTA也能对样品浓度进行直接测量。对一系列浓度为1×108 - 8×108的100纳米单分散样品进行测量,可以看到NTA测量浓度结果和实际浓度存在着很好的线性相关(图3B)。对于多分散体系,测量结果的准确取决于仪器参数的设定(照相机快门速度和光圈),恰当的参数设定可以保证不同大小颗粒都能被NTA软件追踪和计算。
图3 A. 100纳米和300纳米混合样品NTA测量 B. NTA测量浓度和样品实际浓度线性相关
NTA还具有分析荧光样品的能力。NTA有四种不同波长的激光器可以选择,包括405纳米, 488纳米, 532纳米和635纳米的激光器,再搭配相应的滤光片,即可实现对荧光样品的测量。将100纳米的荧光标记的颗粒和200纳米的非荧光颗粒用同一溶剂做成混合样品,使用NTA进行测量(图4)。图4中,蓝色的线显示为NTA的光散射模式,可以看到尽管100纳米和200nm纳米颗粒的分布图有重叠,但还是清楚的区分了100纳米和200纳米的峰值。然后使用荧光滤光片进行分析,只观测到100纳米的荧光标记的纳米颗粒(红线)

图4 NTA荧光样品测量
由于外泌体表面有标志物CD9、CD63等跨膜分子的存在,在复杂的背景环境下(如血清中),可以用荧光抗体标记外泌体,再用NTA的荧光测量功能实现在复杂背景下对外泌体的测量。相比较于流式细胞仪的荧光功能,NTA分辨率较高,且测量荧光颗粒的下限可以达到30-40纳米,而流式细胞仪的测量下限为400纳米。即使对于最新一代的数码流式细胞仪,其测量下限已经达到100纳米,但由于它仍然建立在监测光信号的基础上,所以测量和准确性和分辨率仍然不可靠。所以在外泌体荧光功能测量上,NTA具有独特的优势。
3.总结
对外泌体作为生物标志物的研究目前仍处于起步阶段,但其在临床应用领域已显示出良好的前景。 在临床诊断中,若想在复杂的生物背景下(如血浆,尿液) 简单快速地测量外泌体浓度,需具备外泌体的大小和表征数据。但目前存在的方法都无法完美的解决这一问题。作为一个相对新的测量技术,NTA具有较高的分辨率,提供实时观测以及准确的浓度测量和荧光测量,对外泌体大小和浓度研究提供了新的思路。